Introducción
La teoría cinética molecular se refiere a las leyes matemáticas que representan las velocidades de las
partículas de los gases, lo cual permite calcular, además, otras propiedades, como la presión y la energía
cinética de una cantidad de gas.
En esta unidad, se revisarán los postulados de la teoría cinética molecular, la energía cinética de un gas,
así como los diferentes tipos de velocidad que puede tener, como la velocidad promedio, la más probable y la
cuadrática media.
(s. a.) (s. f.). Velocidades de un gas [imagen]. Tomada de https://www.flickr.com/photos/121935927@N06/13580030964




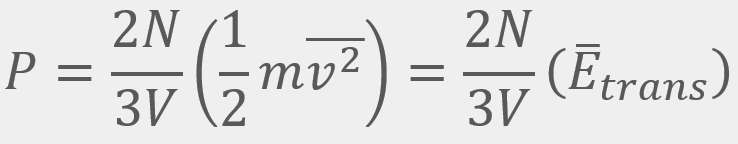
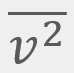 = El promedio de la velocidad al cuadrado
= El promedio de la velocidad al cuadrado
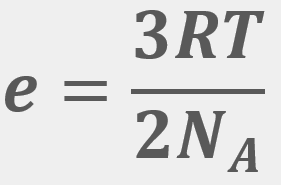
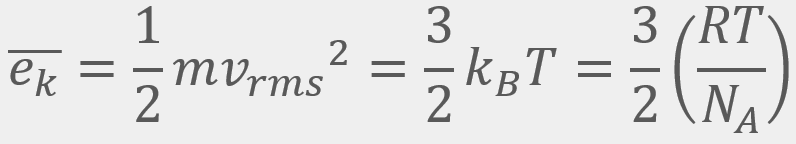
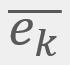 = Energía cinética traslacional promedio
= Energía cinética traslacional promedio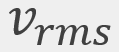 = La velocidad cuadrática media
= La velocidad cuadrática media , que se puede redondear a
, que se puede redondear a 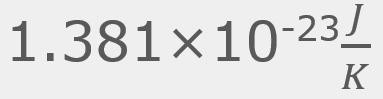

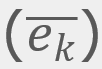 para el
O2, a una temperatura de 298 K, a 1 atm de presión y a una velocidad cuadrática media de 482
para el
O2, a una temperatura de 298 K, a 1 atm de presión y a una velocidad cuadrática media de 482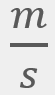 .
.
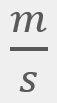

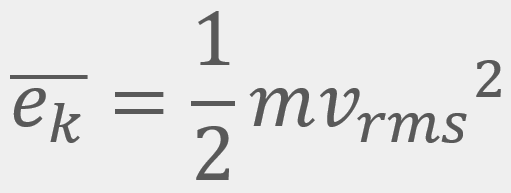
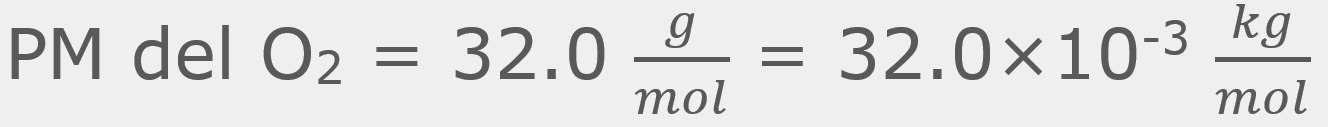
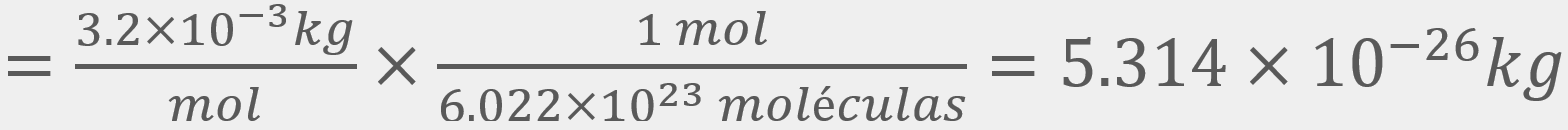
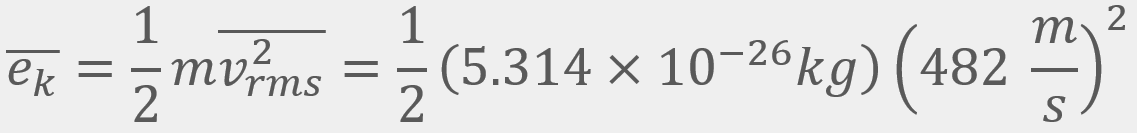
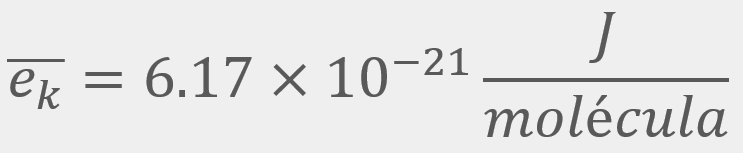

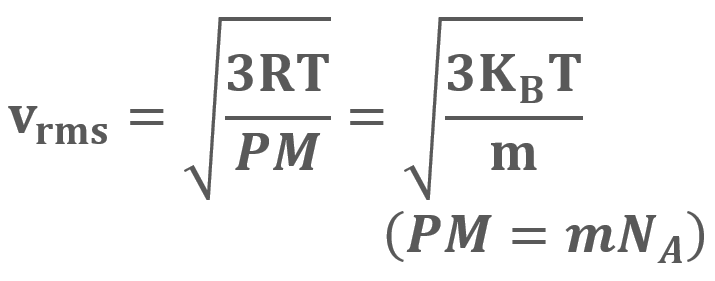
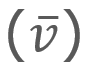 para una cantidad muy grande de moléculas a una temperatura (T) es:
para una cantidad muy grande de moléculas a una temperatura (T) es: 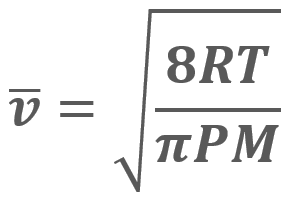
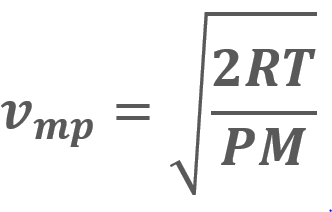
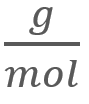
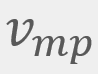 ,
, 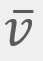 y
y 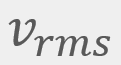 del O2 a 300 K.
del O2 a 300 K.
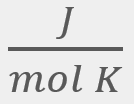
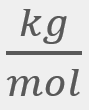
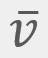 = Velocidad promedio
= Velocidad promedio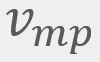 = Velocidad más probable
= Velocidad más probable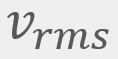 = Velocidad cuadrática media
= Velocidad cuadrática media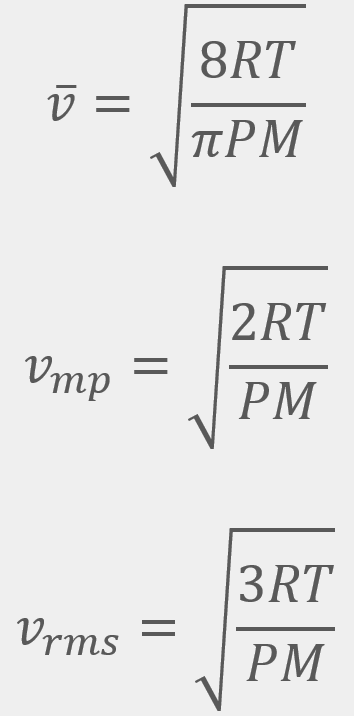
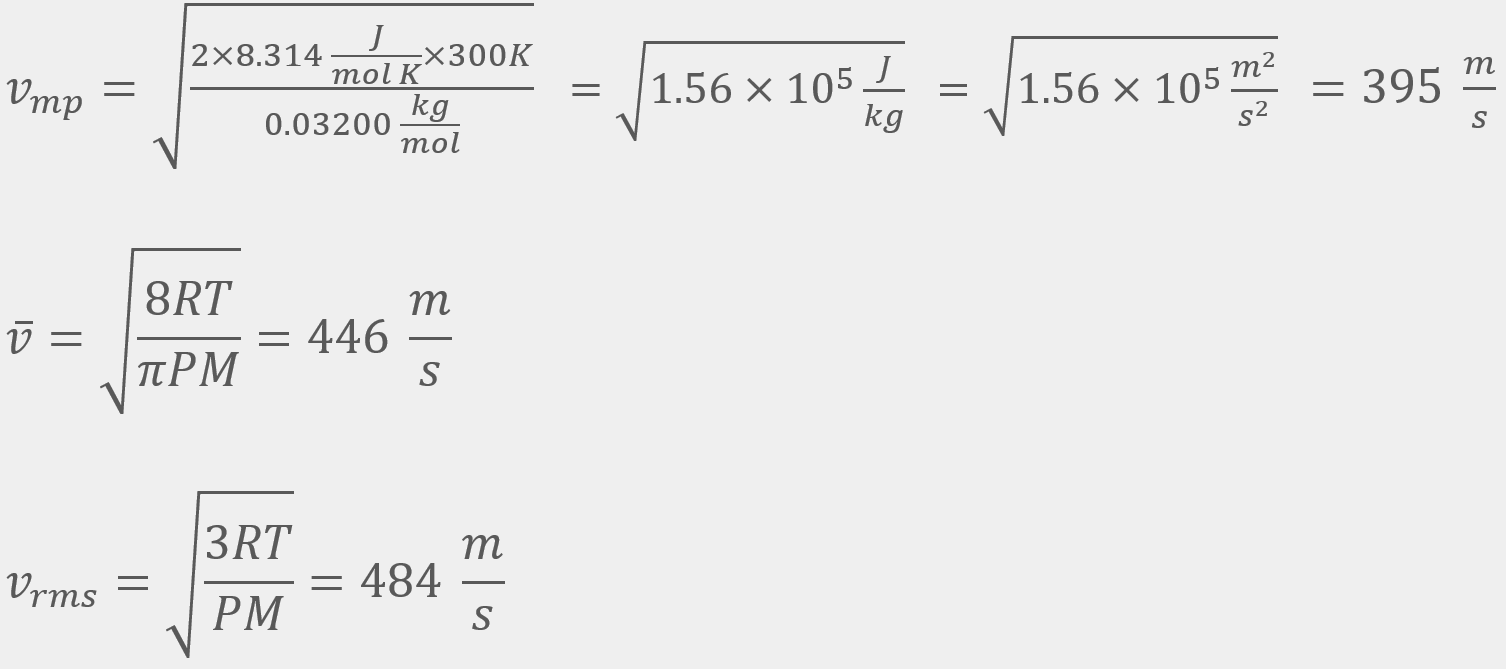
 ; la promedio, de 446
; la promedio, de 446
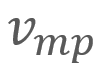 ,
, 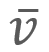 y
y 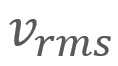 para un grupo de diez automóviles cuyas velocidades registradas por un radar son 38, 44, 45, 48, 50, 55, 55, 57, 58 y 60 km/h, respectivamente.
para un grupo de diez automóviles cuyas velocidades registradas por un radar son 38, 44, 45, 48, 50, 55, 55, 57, 58 y 60 km/h, respectivamente.