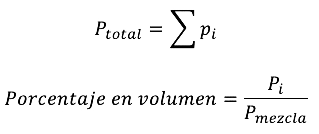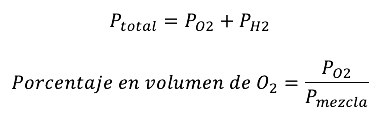Introducción
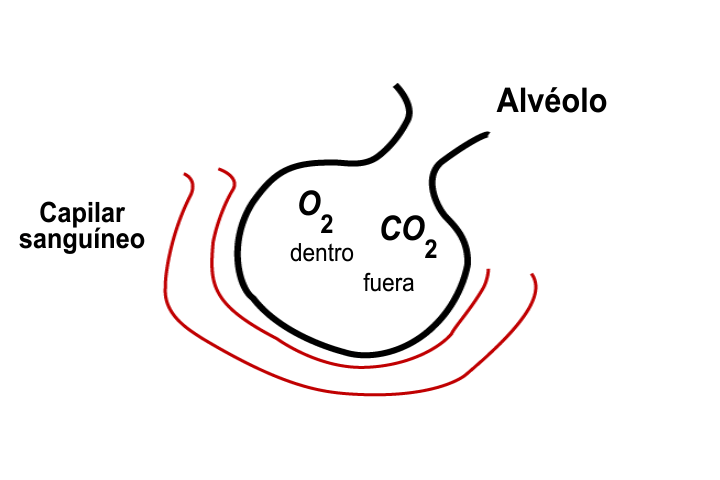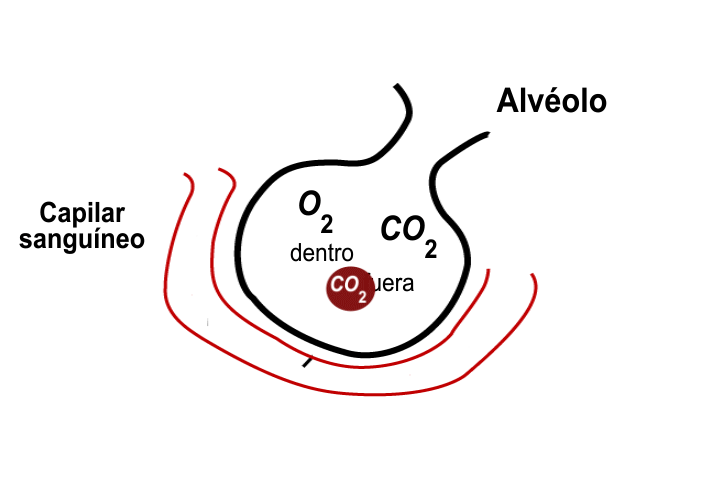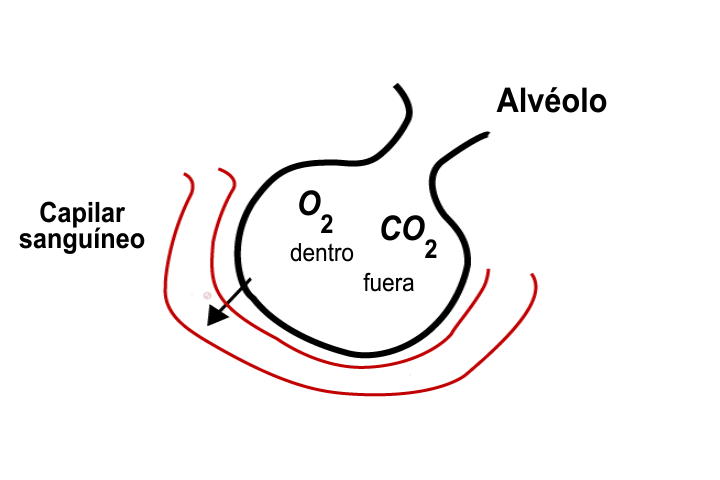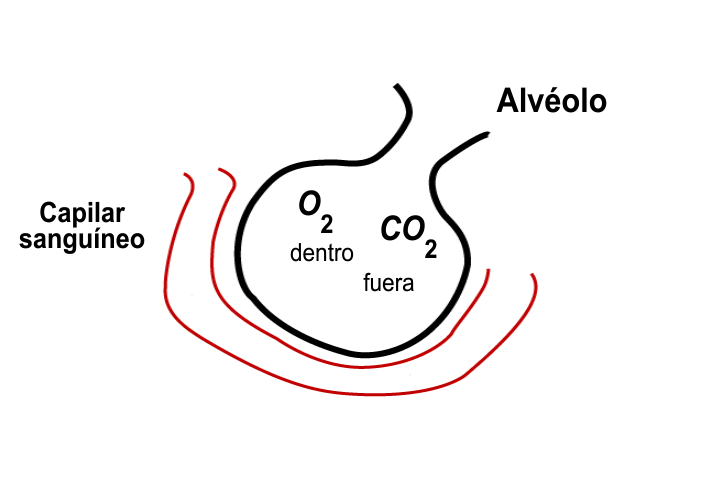
En el deporte del montañismo, los alpinistas o escaladores frecuentemente requieren oxígeno adicional, debido a que la presión parcial de este gas es muy baja para satisfacer la demanda de oxígeno del cuerpo humano.
La ley de Dalton es útil para determinar las presiones parciales en una mezcla de gases; por ejemplo, sabiendo que la presión atmosférica en el monte Everest es de 200 Torr, la parcial del nitrógeno es de 156 Torr y la de otros gases es de 2 Torr, es posible conocer la presión parcial del oxígeno.

(s. a.) (2013). Alpinista escalando el Everest [fotografía]. Tomada de https://upload.wikimedia.org/wikipedia/commons/d/d6/Kuntal_joisher_summit_fullface.jpg