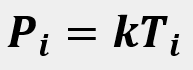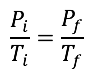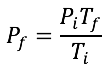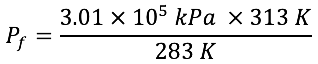Introducción
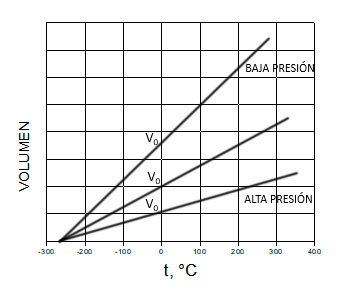
Las leyes empíricas se vinculan con las matemáticas, que describen las relaciones entre las variables de estado —presión, volumen, temperatura— en los gases; se denominan empíricas, debido a que son el resultado de observaciones y numerosos experimentos sobre distintos sistemas gaseosos.
En esta unidad, cuya duración es de una hora, revisarás una de éstas, la ley de Gay-Lussac, desde sus elementos generales hasta el proceso que se sigue cuando se aplica a un problema de impacto biológico. Un ejemplo de su aplicación es cuando las llantas se calientan en una carretera pavimentada en un día muy caluroso; la presión de las llantas se acrecienta como consecuencia del aumento de la temperatura.

(s. a.) (s. f.). Mayor presión de las llantas por el aumento de la temperatura [fotografía]. Tomada de https://www.maxpixel.net/static/photo/1x/Automobiles-Gto-Vintage-Classic-Cars-Hot-Rod-74583.jpg